Model atom Bohr merupakan model atom yang diajukan oleh ilmuwan Niels Bohr pada tahun 1913. Niels Bohr mengajukan teorinya mengenai atom berdasarkan analisis spektrum atom. Berikut model atom yang diajukan oleh Niels Bohr :
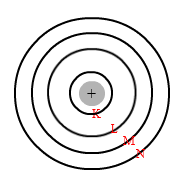
- Dalam atom terdapat lintasan-lintasan tertentu yang disebut kulit atom, yaitu tempat bagi elektron-elektron untuk mengorbit inti tanpa disertai pemancaran atau penyerapan energi. Menurut Niels Bohr, kulit atom adalah orbit berbentuk lingkaran dengan jari-jari tertentu.
Tiap kulit dinyatakan dengan lambang K, L, M, N, dan seterusnya. Masing-masing lintasan ditandai dengan satu bilangan kuantum utama (n) yang dimulai dari 1,2,3,4, dan seterusnya.
Dengan kata lain :
Lintasan pertama ==> kulit K ==> n =1
Lintasan kedua ==> kulit L ==> n = 2
Lintasan ketiga ==> kulit M ==> n = 3 , dan seterusnya.
- Elektron hanya berada pada lintasan-lintasan yang diperbolehkan seusuai dengan tingkat energinya masing-masing. Pada keadaan ground state (tingkat dasar), elektron menempati lintasan dengan tingkat energi terendah. Elektron tidak boleh berada di antara dua lintasan.
- Elektron dapat berpindah dari satu kulit ke kulit lain dengan disertai pelepasan atau penyerapan energi. Pelepasan energi terjadi ketika elektron berpindah dari satu kulit ke kulit yang lebih dalam misal dari L ke K. Sebaliknya, penyerapan enrgi akan terjadi ketika elektron berpindah dari satu kulit ke kulit yang lebih luar misalnya dari K ke L.
Konfigurasi Elektron
Konfigurasi elektron merupakan susunan elektron dalam atom berdasarkan tingkat energi atau kulit. Secara umum konfigurasi elektron dapat ditentukan dengan dua metode yaitu :
- Metode Atom Niels Bohr
- Metode Atom Meaknika kuantum
Semankin besar nomor kulit akan semakin besar pula ruang cakupannya untuk menampung elektron. Dengan kata lain, jumlah elektron yang dapat berada di kulit L akan lebih besar daripada di kulit K. Jumlah maksimum elektron yang dapat ditampung oleh masing-masing kulit mengikuti persamaan berikut :
Berdasarkan ketentuan itu, maka :
Kulit K --> n = 1 --> maksimum = 2 elektron
Kulit L --> n = 2 --> maksimum = 8 elektron
Kulit M --> n = 3--> maksimum = 18 elektron
Kulit N --> n = 4 --> maksimum = 32 elektron
Untuk unsur-unsur yang berada pada golongan utama, berikut beberapa tips menuliskan konfigurasi elektron:
Contoh :
Unsur-unsur golongan IA
zX : K L M N O P Q
1H : 1
3Li : 2 1
11Na : 2 8 1
19K : 2 8 8 1
37Rb : 2 8 18 8 1
55Cs : 2 8 18 18 8 1
87Fr : 2 8 18 32 18 8 1
Unsur-unsur golongan IIA
zX : K L M N O P Q
4Be : 2 2
12Mg : 2 8 2
20Ca : 2 8 8 2
38Sr : 2 8 18 8 2
56Ba : 2 8 18 18 8 2
88Ra : 2 8 18 32 18 8 2
maksimum = 2 n2
Berdasarkan ketentuan itu, maka :
Kulit K --> n = 1 --> maksimum = 2 elektron
Kulit L --> n = 2 --> maksimum = 8 elektron
Kulit M --> n = 3--> maksimum = 18 elektron
Kulit N --> n = 4 --> maksimum = 32 elektron
Untuk unsur-unsur yang berada pada golongan utama, berikut beberapa tips menuliskan konfigurasi elektron:
- Mulai dari lintasan yang paling dekat dengan inti yaitu kulit K.
- Kulit paling luar hanya boleh ditempati maksimal 8 elektron.
- Isi penuh sebanyak mungkin kulit berdasarkan daya tampungnya dan hitung elektron yang tersisa.
- Jika sisa elektron kurang dari 32, maka kulit berikutnya diisi dengan 18 elektron.
- Jika sisa elektron kurang dari 18, maka kulit berikutnya diisi dengan 8 elektron.
- Jika sisa elektron kurang dari 8, maka elektron tersebut ditempatkan pada kulit berikutnya dan merupakan kulit terluar.
Contoh :
Unsur-unsur golongan IA
zX : K L M N O P Q
1H : 1
3Li : 2 1
11Na : 2 8 1
19K : 2 8 8 1
37Rb : 2 8 18 8 1
55Cs : 2 8 18 18 8 1
87Fr : 2 8 18 32 18 8 1
Unsur-unsur golongan IIA
zX : K L M N O P Q
4Be : 2 2
12Mg : 2 8 2
20Ca : 2 8 8 2
38Sr : 2 8 18 8 2
56Ba : 2 8 18 18 8 2
88Ra : 2 8 18 32 18 8 2
Unsur-unsur golongan IIIA
zX : K L M N O P
5B : 2 3
13Al : 2 8 3
31Ga : 2 8 18 3
49In : 2 8 18 18 3
81Ti : 2 8 18 32 18 3
Unsur-unsur golongan IVA
zX : K L M N O P
6C : 2 4
14Si : 2 8 4
32Ge : 2 8 18 4
50Sn : 2 8 18 18 4
82Pb : 2 8 18 32 18 4
Unsur-unsur golongan VA
zX : K L M N O P
7N : 2 5
15P : 2 8 5
33As : 2 8 18 5
51Sb : 2 8 18 18 5
83Bi : 2 8 18 32 18 5
Unsur-unsur golongan VIA
zX : K L M N O P
8O : 2 6
16S : 2 8 6
34Se : 2 8 18 6
52Te : 2 8 18 18 6
84Po : 2 8 18 32 18 6
Unsur-unsur golongan VIIA
zX : K L M N O P
9F : 2 7
17Cl : 2 8 7
35Br : 2 8 18 7
53I : 2 8 18 18 7
85At : 2 8 18 32 18 7
Unsur-unsur golongan VIIIA
zX : K L M N O P
2He : 2
10Ne : 2 8
18Ar : 2 8 8
36Kr : 2 8 18 8
54Xe : 2 8 18 18 8
86Rn : 2 8 18 32 18 8
zX : K L M N O P
5B : 2 3
13Al : 2 8 3
31Ga : 2 8 18 3
49In : 2 8 18 18 3
81Ti : 2 8 18 32 18 3
Unsur-unsur golongan IVA
zX : K L M N O P
6C : 2 4
14Si : 2 8 4
32Ge : 2 8 18 4
50Sn : 2 8 18 18 4
82Pb : 2 8 18 32 18 4
Unsur-unsur golongan VA
zX : K L M N O P
7N : 2 5
15P : 2 8 5
33As : 2 8 18 5
51Sb : 2 8 18 18 5
83Bi : 2 8 18 32 18 5
Unsur-unsur golongan VIA
zX : K L M N O P
8O : 2 6
16S : 2 8 6
34Se : 2 8 18 6
52Te : 2 8 18 18 6
84Po : 2 8 18 32 18 6
Unsur-unsur golongan VIIA
zX : K L M N O P
9F : 2 7
17Cl : 2 8 7
35Br : 2 8 18 7
53I : 2 8 18 18 7
85At : 2 8 18 32 18 7
Unsur-unsur golongan VIIIA
zX : K L M N O P
2He : 2
10Ne : 2 8
18Ar : 2 8 8
36Kr : 2 8 18 8
54Xe : 2 8 18 18 8
86Rn : 2 8 18 32 18 8
Edutafsi.com adalah blog tentang bahan belajar. Gunakan menu atau penelusuran untuk menemukan bahan belajar yang ingin dipelajari.
0 comments :
Post a Comment