Laju reaksi dapat dinyatakan dalam bentuk persamaan seperti yang telah dibahas pada artikel sebelumnya. Dalam persamaan tersebut, terdapat orde reaksi yang menjadi pangkat dari konsentrasi reaktan. Konsentrasi zat pereaksi dan laju reaksi biasanya diperoleh berdasarkan data percobaan, sedangkan orde reaksi harus dihitung terlebih dahulu menggunakan data yang telah diperoleh. Pada kesempatan ini, kita akan membahas tentang definisi order reaksi dan cara mementukan orde reaksi berdasarkan data percobaan.
Pada reaksi sederhana (biasanya berlaku untuk reaksi homogen), orde reaksi dapat ditentukan berdasarkan koefisien reaksinya. Misalnya reaksi A(g) → B(g) memiliki orde reaksi 1 dan A(g) + 2B(g) → C(g) memiliki orde reaksi 1 + 2 = 3. Untuk reaksi yang kompleks, orde reaksi harus ditentukan berdasarkan data percobaan.
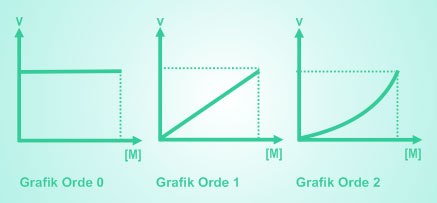
Berdasarkan besar pengaruh konsentrasi reaktan, maka reaksi dapat dibedakan menjadi beberapa jenis yaitu reaksi orde nol, reaksi orde satu, reaksi orde dua, dan reaksi orde negatif. Berikut grafik laju reaksi terhadap konsentrasi untuk orde nol, orde satu, dan orde dua.
Keterangan :
Berikut cara menentukan orde reaksi berdasarkan data percobaan :
Setelah nilai m dan n diperoleh, maka orde reaksi (total) dapat ditentukan. Orde reaksi adalah jumlah dari m ditambah n.
Definisi Orde Reaksi
Orde reaksi adalah bilangan yang menyatakan besar pengaruh konsentrasi reaktan terhadap laju reaksi. Pada persamaan laju reaksi, orde reaksi adalah jumlah dari orde reaksi terhadap masing-masing zat pereaksinya.Pada reaksi sederhana (biasanya berlaku untuk reaksi homogen), orde reaksi dapat ditentukan berdasarkan koefisien reaksinya. Misalnya reaksi A(g) → B(g) memiliki orde reaksi 1 dan A(g) + 2B(g) → C(g) memiliki orde reaksi 1 + 2 = 3. Untuk reaksi yang kompleks, orde reaksi harus ditentukan berdasarkan data percobaan.
Berdasarkan besar pengaruh konsentrasi reaktan, maka reaksi dapat dibedakan menjadi beberapa jenis yaitu reaksi orde nol, reaksi orde satu, reaksi orde dua, dan reaksi orde negatif. Berikut grafik laju reaksi terhadap konsentrasi untuk orde nol, orde satu, dan orde dua.
Keterangan :
- Reaksi Orde NolReaksi orde nol adalah reaksi yang tidak bergantung pada konsentrasi pereaksi. Karena ordenya nol, maka berlaku :
v = k [M]0 = k
Dari persamaan di atas jelas terliha bahwa jika orde reaksi sama dengan nol, maka laju reaksinya akan sama dengan tetapan laju reaksi. Dengan demikian laju reaksinya tetap. Karena tetap, maka grafiknya berbentuk garis lurus mendatar seperti gambar 1 di atas. - Reaksi Orde SatuReaksi orde satu adalah reaksi yang laju reaksinya berbanding lurus dengan konsentrasi pereaksinya. Karena ordenya sama dengan satu, maka berlaku :
v = k [M]1 = k [M]
Persamaan reaksi orde satu merupakan persamaa linear (garis lurus) sehingga bentuk grafiknya berupa grais lurus dengan kemiringan tertentu seperti gambar 2 di atas. - Reaksi Orde DuaReaksi orde dua adalah reaksi yang laju reaksinya berubah secara kuadrat terhadap perubahan konsentrasi pereaksinya. Karena ordenya sama dengan dua, maka berlaku :
v = k [M]2
Persamaan reaksi orde dua merupakan persamaan kuadrat sehingga bentuk grafiknya terlihat (menyerupai grafik eksponensial) seperti gambar tiga di atas. - Reaksi Orde NegatifJika laju reaksi berbanding terbalik dengan konsentrasi reaktan, maka reaksi tersebut merupakan reaksi orde negatif. Karena berbanding terbalik, apabila konsentrasi pereaksi diperbesar, maka laju reaksi akan menjadi lebih kecil.
Penentuan Orde Reaksi
Berikut cara menentukan orde reaksi berdasarkan data percobaan :
- Tentukan persamaan laju reaksinya Secara umum persamaan laju reaksi dapat ditulis sebagai berikut :
v = k [A]m.[B]n
m = orde reaksi terhadap zat A
n = orde reaksi terhadap zat B
m + n = orde reaksi - Tentukan orde reaksi terhadap zat A (m)Untuk menentukan orde reaksi terhadap A (nilai m), lihat percobaan yang konsentrasi zat B-nya sama, kemudian bandingkan persamaan laju reaksinya. Misalnya percobaan yang konsentrasi B-nya sama adalah percobaan nomor 1 dan 2.
⇒ v1 = k [A1]m.[B]n v2 k [A2]m.[B]n
Karena tetapan laju reaksi (k) dan konsentrasi B tetap, maka :
⇒ v1 = [A1]m v2 [A2]m
Dengan :
v1 = laju reaksi pada percobaan nomor 1
v2 = laju reaksi pada percobaan nomor 2
A1 = konsentrasi zat A pada percobaan nomor 1
A2 = konsentrasi zat A pada percobaan nomor 2 - Tentukan orde reaksi terhadap zat B (n)Untuk menentukan orde reaksi terhadap B (nilai n), lihat percobaan yang konsentrasi zat A-nya sama, kemudian bandingkan persamaan laju reaksinya. Misalnya percobaan yang konsentrasi A-nya sama adalah percobaan nomor 1 dan 3.
⇒ v1 = k [A]m.[B1]n v3 k [A]m.[B3]n
Karena tetapan laju reaksi (k) dan konsentrasi B tetap, maka :
⇒ v1 = [B1]n v3 [B3]n
Dengan :
v1 = laju reaksi pada percobaan nomor 1
v3 = laju reaksi pada percobaan nomor 3
B1 = konsentrasi zat B pada percobaan nomor 1
B3 = konsentrasi zat B pada percobaan nomor 3.
Setelah nilai m dan n diperoleh, maka orde reaksi (total) dapat ditentukan. Orde reaksi adalah jumlah dari m ditambah n.
Edutafsi.com adalah blog tentang bahan belajar. Gunakan menu atau penelusuran untuk menemukan bahan belajar yang ingin dipelajari.
0 comments :
Post a Comment