Pembahasan soal SBMPTN bidang study fisika tentang teori kinetik gas dan termodinamika ini meliputi beberapa subtopik dalam bab teori kinetik gas dan termodinamika yaitu sifat-sifat gas ideal, persamaan keadaan gas ideal, proses dan usaha gas, teori kinetik gas ideal, hukum pertama termodinamika, hukum kedua termodinamika, dan mesin kalor. Dari beberapa soal yang pernah keluar dalam soal SBMPTN bidang study fisika, model soal tentang teori kinetik gas dan termodinamika yang sering keluar antara lain menentukan sifat-sifat proses adiabatik, menganalisis proses isobarik suatu gas ideal monoatomik, menentukan momentum rata-rata molekul gas, menganalisis proses siklus yang dialami oleh gas ideal, menentukan jumlah kalor yang dibutuhkan untuk proses peningkatan volume, menentukan usaha yang dilakukan gas dalam proses isobaris, menentukan jumlah partikel gas jika energi kinetik translasi diketahui, menentukan usaha yang dilakukan gas selama proses isotermal dan massa maksimum gas yang dapat disimpan.
Soal 1
Gas ideal dalam suatu ruangan mengalami proses pemuaian secara adiabatik. Pada proses ini ...
A. Dibutuhkan kalor untuk usaha luar
B. Dibutuhkan kalor untuk tambahan energi dalam
C. Tekanan gas ideal bertambah
D. Suhu gas ideal naik
E. Suhu gas ideal turun
Pembahasan :
Proses adiabatik merupakan proses dalam hal ini pemuaian yang ditandai dengan tidak adanya kalor yang masuk atau keluar sistem sehingga berlaku ΔU = -W.
Jika gas memuai secara adiabatik, maka gas melakukan kerja dan mengakibatkan penurunan energi dalam sistem. Energi dalam sistem berkurang sebesar ΔU sehingga suhu gas juga turun.
Soal 2
Suatu gas ideal monoatomik di dalam ruang tertutup mempunyai tekanan 1,2 x 105 Pa dan volume 40 liter. Bila gas memuai secara isobarik sehingga volumenya menjadi 50 liter, maka gas akan menyerap kalor dari lingkungan sebesar 2 x 103 J. Pada akhir proses ...
(1) Suhu gas akan bertambah
(2) Gas melakukan usaha sebesar 1,2 x 103 J
(3) Gas mengalami perubahan energi dalam 800 J
(4) Massa jenis gas bertambah
Pembahasan :
Dik : P = 1,2 x 105 Pa, V1 = 40 L = 0,04 m3, V2 = 50 L = 0,05 m3, Q = 2 x 103 J
Pada proses isobarik, tekanan tetap sehingga berlaku:
⇒ T2 = 5/4 T1
⇒ T2 = 1,25 T1
Karena T2 lebih besar dari T1, berarti suhu gas bertambah (1) Benar.
Usaha yang dilakukan gas untuk proses isobarik:
⇒ W = P.ΔV
⇒ W = P(V2 - V1)
⇒ W = 1,2 x 105 (0,05 - 0,04)
⇒ W = 1,2 x 103 J
Pernyataan (2) Benar.
Karena pernyataan 1 dan 2 benar, maka pernyataan 3 pasti benar. Selanjutnya kita cek pernyataan 4 untuk memastikan jawabannya. Seperti yang kita tahu massa jenis dirumuskan sebagai berikut :
⇒ ρ = m/V
Dari rumus tersebut dapat kita lihat bahwa massa jenis gas berbanding terbalik dengan volume gas. Karena volume gas bertambah dan massanya tetap, maka massa jenis gas berkurang. Pernyataan (4) Salah.
Jadi, opsi yang benar adalah 1 ,2, dan 3.
Baca juga : Pembahasan SBMPTN Fisika Teori Relativitas Khusus.
Soal 3
Dua tabung diisi dengan gas berbeda tetapi keduanya berada pada suhu yang sama. Diketahui Ma dan Mb adalah berat molekul kedua gas tersebut. Dengan demikian, besar momentum rata-rata molekul kedua gas yaitu Pa dan Pb akan berkaitan satu sama lain menurut rumus ...
A. Pa = Pb
B. Pa = Pb √Ma/Mb
C. Pa = Pb x Ma/Mb
D. Pa = Pb x Mb/Ma
E. Pa = Pb √Mb/Ma
Pembahasan :
Momentum partikel
⇒ p = m.v
⇒ p = √3mkT
Perbandingan momentum:
⇒ Pa = Pb √Ma/Mb
Soal 4
Gas ideal yang melakukan pengembangan volume secara isobaris tidak melakukan usaha.
Pembahasan :
Proses isobaris merupakan proses yang dialami oleh suatu gas ideal dimana tekanannya tetap. Gas ideal yang melakukan ekspansi volume secara isobaris melakukan usaha sebesar W = P.ΔV.
Dari rumus tersebut dapat kita lihat bahwa usaha yang dilakukan oleh gas ideal ketika mengembang secara isobaris berbanding lurus dengan perubahan volumenya.
Jadi, pernyataan dan alasan salah.
Baca juga : Pembahasan SBMPTN Fisika Gelombang Bunyi - Efek Doppler.
Soal 5
Satu mol gas ideal mengalami proses isotermal pada suhu T sehingga volumenya menjadi dua kali. Jika R adalah konstanta gas molar, usaha yang dikerjakan oleh gas selama proses tersebut adalah ...
A. RTV
B. RT lnV
C. 2RT
D. RT ln2
E. RT ln(2V)
Pembahasan :
Dik : V2 = 2V1.
Pada proses isotermal, suhunya tetap. Usaha pada proses iostermal:
⇒ W = R T ln (V2/V1)
⇒ W = R T ln (2V1/V1)
⇒ W = R T ln 2
Soal 6
Satu mol gas oksigen dipanasi pada tekanan tetap dan diawali pada temperatur 27o C. Jika diketahui konstanta gas 2 kKal/mol oK, maka jumlah kalor yang diperlukan supaya volume gas menjadi dua kali volume awal adalah ...
A. 0,75 kKal
B. 1,0 kKal
C. 1,5 kKal
D. 3,25 kKal
E. 4,6 kKal
Pembahasan :
Dik : n = 1 mol, T1 = 27o C = 300 K, R = 2 kKal/mol oK, V2 = 2V1.
Pada tekanan tetap (isobaris) berlaku:
⇒ T2 = 600 K
Kalor yang dibutuhkan:
⇒ Q = 5/2 n.R.ΔT
⇒ Q = 5/2 x 1 x 2 (600 - 300)
⇒ Q = 5/2 (600)
⇒ Q = 1500 Kal
⇒ Q = 1,5 kKal.
Baca juga : Pembahasan SBMPTN Fisika Bumi Antariksa - Hukum Keppler.
Soal 7
Dua m3 gas helium bersuhu 27oC dipanaskan secara isobarik sampai 77oC. Jika tekanannya 3 x 105 N/m2, maka usaha yang dilakukan gas adalah ...
A. 100 kJ
B. 140 kJ
C. 200 kJ
D. 260 kJ
E. 320 kJ
Pembahasan :
Dik : T1 = 27o C = 300 K, T2 = 77o C = 350 K, V1 = 2 m3, P = 3 x 105 N/m2.
Untuk proses isobarik berlaku:
⇒ V1 = 7/3 m3.
Usaha yang dilakukan gas:
⇒ W = P.ΔV
⇒ W = P(V2 - V1)
⇒ W = 3 x 105 (7/3 - 2)
⇒ W = 3 x 105 (1/3)
⇒ W = 105 J
⇒ W = 100 kJ.
Soal 8
Tekanan sebuah gas dalam bejana yang volumenya 100 cm3 adalah 200 kPa dan rata-rata energi kinetik translasi masing-masing partikel adalah 6,0 x 10-21 Joule. Jumlah partikel gas pada bejana tersebut adalah ....
A. 3 x 1021
B. 5 x 1021
C. 8 x 1021
D. 10 x 1021
E. 12 x 1021
Pembahasan :
Dik : V = 100 cm3 = 10-4 m3, P = 200 kPa = 2 x 105 N/m2, Ek = 6,0 x 10-21 J
Jumlah partikel gas:
⇒ N = 5 x 10-21
Baca juga : Pembahasan SBMPTN Fisika Inti dan Radioaktivitas.
Soal 9
Suatu gas ideal mengalami proses siklus seperti diagram P-V di bawah ini
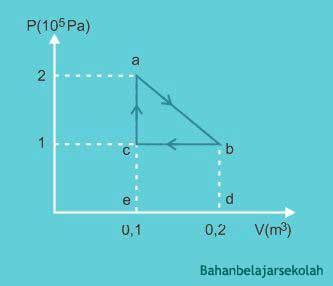
Pernyataan yang benar tentang siklus tersebut adalah ...
(1) Usaha dari a ke b adalah 1,5 x 104 J
(2) Usaha dari b ke c adalah 0,5 x 104 J
(3) Usaha dari c ke a adalah nol
(4) Usaha neto dalam satu siklus adalah 1,0 x 104 J
Pembahasan :
Usaha dari a ke b
⇒ Wab = luas trapesium abde
⇒ Wab = ½ (2 + 1) 105 (0,2 - 0,1)
⇒ Wab = 1,5 x 104 J
Usaha dari b ke c
⇒ Wbc = luas segiempat bced
⇒ Wbc = 1 x 105 (0,1 - 0,2)
⇒ Wbc = -104 J
Karena pernyataan 1 benar dan pernyataan 2 salah, maka bisa dipastikan pernyataan 3 benar dan pernyataan 4 salah. Jadi, opsi yang benar adalah 1 dan 3.
Soal 10
Sebuah tabung gas yang mempunyai katup pengaman akan melepaskan gas dari dalam tabung apabila tekanannya mencapai 2 x106 Pa. Pada suhu 10o C tabung ini dapat berisi gas tertentu maksimum 15 kg. Apabila suhu dinaikkan menjadi 30o C, maka massa maksimum gas yang dapat tersimpan adalah sekitar ...
A. 5,2 kg
B. 14,0 kg
C. 15,1 kg
D. 16,3 kg
E. 45,3 kg
Pembahasan :
Dik : T2 = 30o C = 303 K, T1 = 10o C = 283 K, m1 = 15 kg.
Perubahan gas memenuhi persamaan
Tekanan dan volume gas konstan, sehingga:
⇒ m1.T1 = m2T2
⇒ 15 (283) = 303 m2
⇒ m2 = 14,0 kg.
Soal 1
Gas ideal dalam suatu ruangan mengalami proses pemuaian secara adiabatik. Pada proses ini ...
A. Dibutuhkan kalor untuk usaha luar
B. Dibutuhkan kalor untuk tambahan energi dalam
C. Tekanan gas ideal bertambah
D. Suhu gas ideal naik
E. Suhu gas ideal turun
Pembahasan :
Proses adiabatik merupakan proses dalam hal ini pemuaian yang ditandai dengan tidak adanya kalor yang masuk atau keluar sistem sehingga berlaku ΔU = -W.
Jika gas memuai secara adiabatik, maka gas melakukan kerja dan mengakibatkan penurunan energi dalam sistem. Energi dalam sistem berkurang sebesar ΔU sehingga suhu gas juga turun.
Jawaban : E
Soal 2
Suatu gas ideal monoatomik di dalam ruang tertutup mempunyai tekanan 1,2 x 105 Pa dan volume 40 liter. Bila gas memuai secara isobarik sehingga volumenya menjadi 50 liter, maka gas akan menyerap kalor dari lingkungan sebesar 2 x 103 J. Pada akhir proses ...
(1) Suhu gas akan bertambah
(2) Gas melakukan usaha sebesar 1,2 x 103 J
(3) Gas mengalami perubahan energi dalam 800 J
(4) Massa jenis gas bertambah
Pembahasan :
Dik : P = 1,2 x 105 Pa, V1 = 40 L = 0,04 m3, V2 = 50 L = 0,05 m3, Q = 2 x 103 J
Pada proses isobarik, tekanan tetap sehingga berlaku:
| ⇒ | V1 | = | V2 |
| T1 | T2 |
| ⇒ | 0,04 | = | 0,05 |
| T1 | T2 |
⇒ T2 = 1,25 T1
Karena T2 lebih besar dari T1, berarti suhu gas bertambah (1) Benar.
Usaha yang dilakukan gas untuk proses isobarik:
⇒ W = P.ΔV
⇒ W = P(V2 - V1)
⇒ W = 1,2 x 105 (0,05 - 0,04)
⇒ W = 1,2 x 103 J
Pernyataan (2) Benar.
Karena pernyataan 1 dan 2 benar, maka pernyataan 3 pasti benar. Selanjutnya kita cek pernyataan 4 untuk memastikan jawabannya. Seperti yang kita tahu massa jenis dirumuskan sebagai berikut :
⇒ ρ = m/V
Dari rumus tersebut dapat kita lihat bahwa massa jenis gas berbanding terbalik dengan volume gas. Karena volume gas bertambah dan massanya tetap, maka massa jenis gas berkurang. Pernyataan (4) Salah.
Jadi, opsi yang benar adalah 1 ,2, dan 3.
Jawaban : A
Baca juga : Pembahasan SBMPTN Fisika Teori Relativitas Khusus.
Soal 3
Dua tabung diisi dengan gas berbeda tetapi keduanya berada pada suhu yang sama. Diketahui Ma dan Mb adalah berat molekul kedua gas tersebut. Dengan demikian, besar momentum rata-rata molekul kedua gas yaitu Pa dan Pb akan berkaitan satu sama lain menurut rumus ...
A. Pa = Pb
B. Pa = Pb √Ma/Mb
C. Pa = Pb x Ma/Mb
D. Pa = Pb x Mb/Ma
E. Pa = Pb √Mb/Ma
Pembahasan :
Momentum partikel
⇒ p = m.v
| ⇒ p = m | √3kT |
| √m |
Perbandingan momentum:
| ⇒ | pa | = | √3Ma.kT |
| pb | √3Mb.kT |
| ⇒ | pa | = | √Ma |
| pb | √Mb |
Jawaban : B
Soal 4
Gas ideal yang melakukan pengembangan volume secara isobaris tidak melakukan usaha.
SEBAB
Usaha yang dilakukan oleh gas ideal ketika mengembang sebanding dengan perubahan tekanan gas.Pembahasan :
Proses isobaris merupakan proses yang dialami oleh suatu gas ideal dimana tekanannya tetap. Gas ideal yang melakukan ekspansi volume secara isobaris melakukan usaha sebesar W = P.ΔV.
Dari rumus tersebut dapat kita lihat bahwa usaha yang dilakukan oleh gas ideal ketika mengembang secara isobaris berbanding lurus dengan perubahan volumenya.
Jadi, pernyataan dan alasan salah.
Jawaban : E
Baca juga : Pembahasan SBMPTN Fisika Gelombang Bunyi - Efek Doppler.
Soal 5
Satu mol gas ideal mengalami proses isotermal pada suhu T sehingga volumenya menjadi dua kali. Jika R adalah konstanta gas molar, usaha yang dikerjakan oleh gas selama proses tersebut adalah ...
A. RTV
B. RT lnV
C. 2RT
D. RT ln2
E. RT ln(2V)
Pembahasan :
Dik : V2 = 2V1.
Pada proses isotermal, suhunya tetap. Usaha pada proses iostermal:
⇒ W = R T ln (V2/V1)
⇒ W = R T ln (2V1/V1)
⇒ W = R T ln 2
Jawaban : D
Soal 6
Satu mol gas oksigen dipanasi pada tekanan tetap dan diawali pada temperatur 27o C. Jika diketahui konstanta gas 2 kKal/mol oK, maka jumlah kalor yang diperlukan supaya volume gas menjadi dua kali volume awal adalah ...
A. 0,75 kKal
B. 1,0 kKal
C. 1,5 kKal
D. 3,25 kKal
E. 4,6 kKal
Pembahasan :
Dik : n = 1 mol, T1 = 27o C = 300 K, R = 2 kKal/mol oK, V2 = 2V1.
Pada tekanan tetap (isobaris) berlaku:
| ⇒ | V1 | = | V2 |
| T1 | T2 |
| ⇒ | V1 | = | 2V1 |
| 300 | T2 |
Kalor yang dibutuhkan:
⇒ Q = 5/2 n.R.ΔT
⇒ Q = 5/2 x 1 x 2 (600 - 300)
⇒ Q = 5/2 (600)
⇒ Q = 1500 Kal
⇒ Q = 1,5 kKal.
Jawaban : C
Baca juga : Pembahasan SBMPTN Fisika Bumi Antariksa - Hukum Keppler.
Soal 7
Dua m3 gas helium bersuhu 27oC dipanaskan secara isobarik sampai 77oC. Jika tekanannya 3 x 105 N/m2, maka usaha yang dilakukan gas adalah ...
A. 100 kJ
B. 140 kJ
C. 200 kJ
D. 260 kJ
E. 320 kJ
Pembahasan :
Dik : T1 = 27o C = 300 K, T2 = 77o C = 350 K, V1 = 2 m3, P = 3 x 105 N/m2.
Untuk proses isobarik berlaku:
| ⇒ | V1 | = | V2 |
| T1 | T2 |
| ⇒ | 2 | = | V1 |
| 300 | 350 |
Usaha yang dilakukan gas:
⇒ W = P.ΔV
⇒ W = P(V2 - V1)
⇒ W = 3 x 105 (7/3 - 2)
⇒ W = 3 x 105 (1/3)
⇒ W = 105 J
⇒ W = 100 kJ.
Jawaban : A
Soal 8
Tekanan sebuah gas dalam bejana yang volumenya 100 cm3 adalah 200 kPa dan rata-rata energi kinetik translasi masing-masing partikel adalah 6,0 x 10-21 Joule. Jumlah partikel gas pada bejana tersebut adalah ....
A. 3 x 1021
B. 5 x 1021
C. 8 x 1021
D. 10 x 1021
E. 12 x 1021
Pembahasan :
Dik : V = 100 cm3 = 10-4 m3, P = 200 kPa = 2 x 105 N/m2, Ek = 6,0 x 10-21 J
Jumlah partikel gas:
| ⇒ N = 3/2 | PV |
| Ek |
| ⇒ N = 3/2 | (2 x 105)(10-4) |
| 6,0 x 10-21 |
| ⇒ N = | 30 |
| 6,0 x 10-21 |
Jawaban : B
Baca juga : Pembahasan SBMPTN Fisika Inti dan Radioaktivitas.
Soal 9
Suatu gas ideal mengalami proses siklus seperti diagram P-V di bawah ini
Pernyataan yang benar tentang siklus tersebut adalah ...
(1) Usaha dari a ke b adalah 1,5 x 104 J
(2) Usaha dari b ke c adalah 0,5 x 104 J
(3) Usaha dari c ke a adalah nol
(4) Usaha neto dalam satu siklus adalah 1,0 x 104 J
Pembahasan :
Usaha dari a ke b
⇒ Wab = luas trapesium abde
⇒ Wab = ½ (2 + 1) 105 (0,2 - 0,1)
⇒ Wab = 1,5 x 104 J
Usaha dari b ke c
⇒ Wbc = luas segiempat bced
⇒ Wbc = 1 x 105 (0,1 - 0,2)
⇒ Wbc = -104 J
Karena pernyataan 1 benar dan pernyataan 2 salah, maka bisa dipastikan pernyataan 3 benar dan pernyataan 4 salah. Jadi, opsi yang benar adalah 1 dan 3.
Jawaban : B
Soal 10
Sebuah tabung gas yang mempunyai katup pengaman akan melepaskan gas dari dalam tabung apabila tekanannya mencapai 2 x106 Pa. Pada suhu 10o C tabung ini dapat berisi gas tertentu maksimum 15 kg. Apabila suhu dinaikkan menjadi 30o C, maka massa maksimum gas yang dapat tersimpan adalah sekitar ...
A. 5,2 kg
B. 14,0 kg
C. 15,1 kg
D. 16,3 kg
E. 45,3 kg
Pembahasan :
Dik : T2 = 30o C = 303 K, T1 = 10o C = 283 K, m1 = 15 kg.
Perubahan gas memenuhi persamaan
| ⇒ | P1.V1 | = | P2.V2 |
| m1.T1 | m2T2 |
Tekanan dan volume gas konstan, sehingga:
| ⇒ | 1 | = | 1 |
| m1.T1 | m2T2 |
⇒ 15 (283) = 303 m2
⇒ m2 = 14,0 kg.
Jawaban : B
Edutafsi.com adalah blog tentang bahan belajar. Gunakan menu atau penelusuran untuk menemukan bahan belajar yang ingin dipelajari.
0 comments :
Post a Comment