Edutafsi.com - Model Atom Mekanika Kuantum. Meskipun teori dan model atom Bohr berhasil menjawab dan menyelesaikan berbagai kesulitan atau kelemahan dalam teori atom Rutherford, namun teori atom Bohr juga mengandung beberapa kelemahan yang cukup signifikan. Teori tersebut tidak dapat menerangkan spektrum atom yang lebih besar daripada hidrogen dan tidak mampu menerangkan efek Zeeman. Kelemahan tersebut pun berhasil disempurnakan oleh seorang ilmuwan bernama Erwin Schrodinger yang mengajukan teori dan model atom mekanika kuantum atau dikenal juga sebagai model atom modern. Lalu, apakah kelebihan teori ini dibanding teori atom Bohr? Adakah kelemahan dalam teori atom modern?
Jika elektron dipandang sebagai partikel dan gelombang, maka kedudukan elektron di dalam lintasanya tidak dapat ditentukan dengan pasti seperti yang digambarkan Bohr dalam model atom Bohr. Itu artinya, orbit elektron bukanlah berbentuk lingkaran dengan jari-jari tertentu. Lalu, bagaimana bentuk lintasan tersebut?
Kedudukan dan pergerakan elektron di dalam atom dapat dijelaskan dengan baik oleh teori atom modern yang diajukan oleh Erwin Schrodinger. Model atom mekanika kuantum menggambarkan sifat pergerakan dan kedudukan elektron dengan berdasarkan pada hipotesis de Broglie.
Menurut Louis de Broglie, pada elektron juga berlaku sifat dualisme, yaitu elektron buka hanya sekedar partikel melainkan juga bersifat sebagai gelombang. Dengan demikian, elektron begerak layaknya gelombang dan memiliki lintasan yang juga merupakan gelombang.
Teori model atom modern juga berdasarkan pada asas ketidakpastian Heisenberg. Menurut asas ketidakpastian Heisenberg, kedudukan elektron tidak dapat ditentukan secara pasti. Meski begitu, dapat ditentukan kebolehjadian atau peluang ditemukannya elektron pada suatu posisi dengan jarak tertentu dari inti atom.
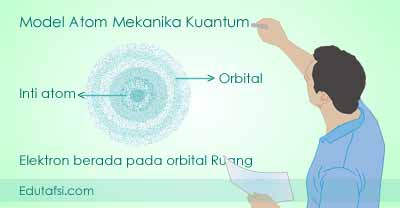
Berdasarkan pada dua teori tersebut, Erwin Schrodinger akhirnya berhasil merumuskan persamaan gelombang gerakan elektron dalam suatu atom. Persamaan tersebut merupakan persamaan dalam bentuk fungsi ruang tiga dimensi. Rumusan tersebut menjelaskan bahwa lintasan elektron bukan berupa garis pasti melainkan sebuah ruang.
Sesuai dengan asas ketidakpastian Heisenberg, teori atom modern menjelaskan bahwa elektron boleh jadi berpeluang berada pada ruang tersebut. Ruang tempat dimana elektron berpeluang ditemukan disebut dengan istilah orbital. Orbital merupakan daerah kemungkinan terbesar ditemukannya elektron.
Dengan demikian, berikut beberapa poin dalam teori atom mekanika kuantum:
1). Atom memiliki kulit dan setiap kulit memiliki subkulit
2). Lintasan elektron bukan berupa garis lingkaran melainkan ruang
3). Pergerakan elektron dalam lintasannya merupakan gelombang
4). Posisi elektron dalam atom tidak dapat ditentukan dengan pasti.
Menurut model atom modern, orbital digambarkan berupa awan, yang tebal tipisnya menyatakan besar kecilnya kemungkinan ditemukan elektron di daerah tersebut. Werner Heisenberg juga mengemukakan bahwa metode eksperimen yang digunakan untuk menemukan posisi atau momentum suatu partikel seperti elektron dapat menyebabkan perubahan, baik pada posisi, momentum atau keduanya.
Berikut beberapa kelebihan teori atom modern:
1). Dapat menjelaskan posisi kebolehjadian ditemukannya elektron
2). Dapat menjelaskan posisi elektron saat mengorbit
3). Dapat mengukur perpindahan energi eksitasi dan emisinya
4). Mengidentifikasi proton dan neutron pada inti sedanga elektron berada pada orbitalnya.
Teori model atom modern didukung dengan rumsuan persamaan gelombang yang ditemukan oleh Schrodinger, yaitu persamaan berupa fungsi suatu ruang tiga dimensi. Kelemahannya, persamaan ini hanya dapat diterapkan secara eksak untuk partikel dalam kotak dan atom dengan elektron tunggal. Model atom modern juga sulit diterapkan untuk sistem makroskopis dengan kumpulan atom misalnya hewan.
A. Teori dan Model Atom Modern
Kemampuan Niels Bohr menjawab kelemahan teori atom Rutherford memang menjadi titik terang dalam perkembangan teori tentang struktur atom. Akan tetapi, seiring dengan perkembangannya, diketahui bahwa gerakan elektron ternyata menyerupai gelombang sehingga posisinya tidak dapat ditentukan dengan pasti. Kenyataan inilah yang kemudian turut menggugurkan teori atom Bohr.Jika elektron dipandang sebagai partikel dan gelombang, maka kedudukan elektron di dalam lintasanya tidak dapat ditentukan dengan pasti seperti yang digambarkan Bohr dalam model atom Bohr. Itu artinya, orbit elektron bukanlah berbentuk lingkaran dengan jari-jari tertentu. Lalu, bagaimana bentuk lintasan tersebut?
Kedudukan dan pergerakan elektron di dalam atom dapat dijelaskan dengan baik oleh teori atom modern yang diajukan oleh Erwin Schrodinger. Model atom mekanika kuantum menggambarkan sifat pergerakan dan kedudukan elektron dengan berdasarkan pada hipotesis de Broglie.
Menurut Louis de Broglie, pada elektron juga berlaku sifat dualisme, yaitu elektron buka hanya sekedar partikel melainkan juga bersifat sebagai gelombang. Dengan demikian, elektron begerak layaknya gelombang dan memiliki lintasan yang juga merupakan gelombang.
Teori model atom modern juga berdasarkan pada asas ketidakpastian Heisenberg. Menurut asas ketidakpastian Heisenberg, kedudukan elektron tidak dapat ditentukan secara pasti. Meski begitu, dapat ditentukan kebolehjadian atau peluang ditemukannya elektron pada suatu posisi dengan jarak tertentu dari inti atom.
Berdasarkan pada dua teori tersebut, Erwin Schrodinger akhirnya berhasil merumuskan persamaan gelombang gerakan elektron dalam suatu atom. Persamaan tersebut merupakan persamaan dalam bentuk fungsi ruang tiga dimensi. Rumusan tersebut menjelaskan bahwa lintasan elektron bukan berupa garis pasti melainkan sebuah ruang.
Sesuai dengan asas ketidakpastian Heisenberg, teori atom modern menjelaskan bahwa elektron boleh jadi berpeluang berada pada ruang tersebut. Ruang tempat dimana elektron berpeluang ditemukan disebut dengan istilah orbital. Orbital merupakan daerah kemungkinan terbesar ditemukannya elektron.
Dengan demikian, berikut beberapa poin dalam teori atom mekanika kuantum:
1). Atom memiliki kulit dan setiap kulit memiliki subkulit
2). Lintasan elektron bukan berupa garis lingkaran melainkan ruang
3). Pergerakan elektron dalam lintasannya merupakan gelombang
4). Posisi elektron dalam atom tidak dapat ditentukan dengan pasti.
Menurut model atom modern, orbital digambarkan berupa awan, yang tebal tipisnya menyatakan besar kecilnya kemungkinan ditemukan elektron di daerah tersebut. Werner Heisenberg juga mengemukakan bahwa metode eksperimen yang digunakan untuk menemukan posisi atau momentum suatu partikel seperti elektron dapat menyebabkan perubahan, baik pada posisi, momentum atau keduanya.
B. Keunggulan dan Kekurangan Model Atom Mekanika Kuantum
Teori dan model atom mekanika kuantum yang diajukan oleh Erwin Schrodinger berhasil menyempurnakan beberapa kelemahan yang ada dalan teori atom Bohr sekaligus membuka pemahamn baru mengenai struktur atom dan pegerakan elektron di dalam atom.Berikut beberapa kelebihan teori atom modern:
1). Dapat menjelaskan posisi kebolehjadian ditemukannya elektron
2). Dapat menjelaskan posisi elektron saat mengorbit
3). Dapat mengukur perpindahan energi eksitasi dan emisinya
4). Mengidentifikasi proton dan neutron pada inti sedanga elektron berada pada orbitalnya.
Teori model atom modern didukung dengan rumsuan persamaan gelombang yang ditemukan oleh Schrodinger, yaitu persamaan berupa fungsi suatu ruang tiga dimensi. Kelemahannya, persamaan ini hanya dapat diterapkan secara eksak untuk partikel dalam kotak dan atom dengan elektron tunggal. Model atom modern juga sulit diterapkan untuk sistem makroskopis dengan kumpulan atom misalnya hewan.
Edutafsi.com adalah blog tentang bahan belajar. Gunakan menu atau penelusuran untuk menemukan bahan belajar yang ingin dipelajari.