Edutafsi.com - Keelektronegatifan Unsur. Jika dilihat berdasarkan kecenderungan suatu unsur untuk melepas atau menyerap elektron untuk membentuk ion, maka ada dua sifat periodik yang telah dibahas pada artikel sebelumnya. Kedua sifat tersebut adalah energi ionisasi dan afinitas elektron. Energi ionisasi menunjukkan kecenderungan unsur dalam melepas elektron dan membentuk ion positif sedangkan afinitas elektron menunjukkan kecenderungan unsur dalam menyerap elektron dan membentuk ion negatif. Selain kedua sifat tersebut, masih ada satu lagi sifat periodik unsur yang menyatakan kecenderungan unsur dalam menarik elektron, yang disebut keelektronegatifan.
Sekilas, ketiga istilah atau sifat tersebut memang terlihat sama, karena ketiganya membahas mengenai kecenderungan unsur dalam melepas atau menangkap elektron. Akan tetapi, energi ionisasi dan afinitas elektron membahas kecenderungan tersebut terkait pembentukan ion. Sedangkan keelektronegatifan lebih ditujukan pada suatu ikatan kimia.
Secara sederhana, keelektronegatifan dapat diartikan sebagai suatu bilangan yang menggambarkan kecenderungan suatu unsur untuk menarik elektron ke pihaknya dalam suatu ikatan kimia. Jadi, keelektronegatifan tidak dikaitkan dengan pembentukan ion seperti halnya energi ionisasi dan afinitas elektron.
Dengan kata lain, keelektronegatifan menunjukkan kecenderungan suatu unsur untuk bereaksi dengan unsur lain dan membentuk ikatan kimia. Harga keelektronegatifan bersifat relatif yaitu hanya berupa harga perbandingan suatu atom dengan atom lainnya.
Unsur yang memiliki harga keelektronegatifan besar, umumnya cenderung menerima elektron dan membentuk bilangan oksidasi (biloks) negatif. Sebaliknya, jika unsur memiliki harga keelektronegatifan kecil, maka unsur tersebut cenderung melepas elektron membentu bilangan oksidasi positif.
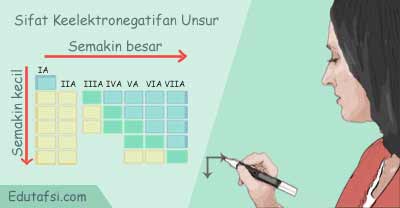
Lalu bagaimana kecenderungan sifat keelektronegatifan unsur dalam sistem periodik? Mesi terdapat beberapa penyimpangan di beberapa titik, namun kecenderungan sifat keelektronegatifan unsur dapat disimpulkan sebagai berikut:
1). Dari atas ke bawah dalam satu golongan, keelektronegatifan berkurang
2). Dari kiri ke kanan dalam satu periode, keelektronegatifan bertambah.
Berikut harga keelektronegatifan dari beberapa unsur golongan utama:
1). Golongan IA : H(2,1), Li(1,0), Na(0,9), K(0,8), Rb(0,8)
2). Golongan IIA : Be(1,5), Mg(1,2), Ca(1,0), Sr(1,0), Ba(0,9)
3). Golongan IIIA : B(2,0), Al(1,5), Ga(1,6)
4). Golongan IVA : C(2,5), Si(1,8), Ge(1,8)
5). Golongan VA : N(3,0), P(2,1), As(2,0), Sb(1,9)
6). Golongan VIA : O(3,5), S(2,5), Se(2,4), Te(2,1), Po(1,9)
7). Golongan VIIA : F(4,0), Cl(3,0), Br(2,8), I(2,5), At(2,1).
Pada ilustrasi di atas ditunjukkan bagaimana kecenderungan sifat keelektronegatifan unsur-unsur golongan utama (IA - VIIA). Golongan VIIIA tidak dimasukkan dalam daftar karena golongan gas mulia umumnya berupa gas yang sangat stabil sehingga tidak reaktif.
Unsur gas mulia (golongan VIIIA) terdapat di alam dalam wujud gas monoatomik yaitu atom-atomnya berdiri sendiri. Golongan gas mulia memiliki kulit terluar yang sudah terisi penuh sehingga membuat unsur-unsur tersebut tidak reaktif.
Kecenderungan keelektronegatifan unsur sebenarnya berhubungan dengan energi ionisasi dan afinitas elektron. Unsur yang memiliki energi ionisasi dan afinitas elektron yang besar cenderung memiliki keelektronegatifan yang besar.
Sebaliknya, unsur yang memiliki energi ionisasi dan afinitas elektron yang kecil cenderung memiliki keelketronegatifan yang kecil pula. Kecenderungan ini pun berkaitan dengan sifat kereaktfian suatu unsur. Kereaktifan suatu unsur bergantung pada kecenderungan unsur tersebut melapas atau menarik elektron.
Dalam sistem periodik unsur, unsur logam golongan utama yang paling reaktif adalah unsur-unsur golongan IA atau golongan logam alkali. Sedangkan unsur nonlogam yang paling reaktif adalah unsur-unsur yang berada pada golongan VIIA atau golongan halogen.
Demikianlah pembahasan singkat mengenai kecenderungan sifat keelektronegatifan unsur dalam sistem periodik. Jika bahan belajar ini bermanfaat, bantu kami membagikannya kepada teman anda melalui tombol share yang tersedia di bawah ini. Terimakasih.
Sekilas, ketiga istilah atau sifat tersebut memang terlihat sama, karena ketiganya membahas mengenai kecenderungan unsur dalam melepas atau menangkap elektron. Akan tetapi, energi ionisasi dan afinitas elektron membahas kecenderungan tersebut terkait pembentukan ion. Sedangkan keelektronegatifan lebih ditujukan pada suatu ikatan kimia.
Secara sederhana, keelektronegatifan dapat diartikan sebagai suatu bilangan yang menggambarkan kecenderungan suatu unsur untuk menarik elektron ke pihaknya dalam suatu ikatan kimia. Jadi, keelektronegatifan tidak dikaitkan dengan pembentukan ion seperti halnya energi ionisasi dan afinitas elektron.
Dengan kata lain, keelektronegatifan menunjukkan kecenderungan suatu unsur untuk bereaksi dengan unsur lain dan membentuk ikatan kimia. Harga keelektronegatifan bersifat relatif yaitu hanya berupa harga perbandingan suatu atom dengan atom lainnya.
Unsur yang memiliki harga keelektronegatifan besar, umumnya cenderung menerima elektron dan membentuk bilangan oksidasi (biloks) negatif. Sebaliknya, jika unsur memiliki harga keelektronegatifan kecil, maka unsur tersebut cenderung melepas elektron membentu bilangan oksidasi positif.
Lalu bagaimana kecenderungan sifat keelektronegatifan unsur dalam sistem periodik? Mesi terdapat beberapa penyimpangan di beberapa titik, namun kecenderungan sifat keelektronegatifan unsur dapat disimpulkan sebagai berikut:
1). Dari atas ke bawah dalam satu golongan, keelektronegatifan berkurang
2). Dari kiri ke kanan dalam satu periode, keelektronegatifan bertambah.
Berikut harga keelektronegatifan dari beberapa unsur golongan utama:
1). Golongan IA : H(2,1), Li(1,0), Na(0,9), K(0,8), Rb(0,8)
2). Golongan IIA : Be(1,5), Mg(1,2), Ca(1,0), Sr(1,0), Ba(0,9)
3). Golongan IIIA : B(2,0), Al(1,5), Ga(1,6)
4). Golongan IVA : C(2,5), Si(1,8), Ge(1,8)
5). Golongan VA : N(3,0), P(2,1), As(2,0), Sb(1,9)
6). Golongan VIA : O(3,5), S(2,5), Se(2,4), Te(2,1), Po(1,9)
7). Golongan VIIA : F(4,0), Cl(3,0), Br(2,8), I(2,5), At(2,1).
Pada ilustrasi di atas ditunjukkan bagaimana kecenderungan sifat keelektronegatifan unsur-unsur golongan utama (IA - VIIA). Golongan VIIIA tidak dimasukkan dalam daftar karena golongan gas mulia umumnya berupa gas yang sangat stabil sehingga tidak reaktif.
Unsur gas mulia (golongan VIIIA) terdapat di alam dalam wujud gas monoatomik yaitu atom-atomnya berdiri sendiri. Golongan gas mulia memiliki kulit terluar yang sudah terisi penuh sehingga membuat unsur-unsur tersebut tidak reaktif.
Kecenderungan keelektronegatifan unsur sebenarnya berhubungan dengan energi ionisasi dan afinitas elektron. Unsur yang memiliki energi ionisasi dan afinitas elektron yang besar cenderung memiliki keelektronegatifan yang besar.
Sebaliknya, unsur yang memiliki energi ionisasi dan afinitas elektron yang kecil cenderung memiliki keelketronegatifan yang kecil pula. Kecenderungan ini pun berkaitan dengan sifat kereaktfian suatu unsur. Kereaktifan suatu unsur bergantung pada kecenderungan unsur tersebut melapas atau menarik elektron.
Dalam sistem periodik unsur, unsur logam golongan utama yang paling reaktif adalah unsur-unsur golongan IA atau golongan logam alkali. Sedangkan unsur nonlogam yang paling reaktif adalah unsur-unsur yang berada pada golongan VIIA atau golongan halogen.
Demikianlah pembahasan singkat mengenai kecenderungan sifat keelektronegatifan unsur dalam sistem periodik. Jika bahan belajar ini bermanfaat, bantu kami membagikannya kepada teman anda melalui tombol share yang tersedia di bawah ini. Terimakasih.
Edutafsi.com adalah blog tentang bahan belajar. Gunakan menu atau penelusuran untuk menemukan bahan belajar yang ingin dipelajari.