Hukum Hess adalah hukum yang digunakan untuk menentukan besarnya perubahan entalpi suatu reaksi. Dalam hukum Hess, nilai perubahan entalpi dinyatakan sebagai fungsi keadaan (∆H). Menurut hukum ini, karena perubahan entalpi merupakan fungsi keadaan maka perubahan reaksi kimia akan bernilai sama meskipun langkah-langkah yang diperlukan untuk menghasilkan hasil reaksi berbeda.
Dengan kata lain, perubahan entalpi suatu reaksi hanya ditentukan oleh keadaan awal dan keadaan akhir reaksi dan tidak bergantung pada jalannya reaksi.
Dengan kata lain, perubahan entalpi suatu reaksi hanya ditentukan oleh keadaan awal dan keadaan akhir reaksi dan tidak bergantung pada jalannya reaksi.
Perubahan entalpi suatu reaksi kimia merupakan selisih nilai entalpi pembentukan hasil reaksi dan entalpi pembentukan pereaksi. Secara matematis dapat ditulis sebagai berikut :
∆H = ∆Hf hasil reaksi - ∆Hf pereaksi
∆H = ∆H1 + ∆H2
Kumpulan soal :
- Hitunglah jumlah kalor yang dibebaskan pada pembakaran 1 mol hidrokarbon C2H2 (mr = 26) bila diketahui entalpi pembentukan H2O(g) = -285 kJ/mol, CO2(g) = -393 kJ/mol dan C2H2(g) = +227 kJ/mol.
Pembahasan :
Pertama-tama, hal yang harus kita lakukan adalah membuat persamaan reaksi untuk pembakaran C2H2. Ingat bahwa pembakaran artinya senyawa direaksikan dengan oksigen (O2). Reaksi pembakaran hidrokarbon selalu menghasilkan karbondioksida dan uap air. Setelah disetarakan akan dihasilkan persamaan reaksi seperti berikut :
∆Hreaksi = ∆H hasil - ∆H pereaksi
∆Hreaksi = 2 ∆Hf CO2 + ∆Hf H2O - ∆Hf C2H2 - 5/2 ∆Hf O2
∆Hreaksi = 2 (-393) + (-285) - 227 - 5/2 (0)
∆Hreaksi = -1298 kJ/mol.
Ingat bahwa ∆H unsur-unsur bernilai 0 sehingga ∆Hf O2 = 0
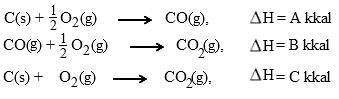
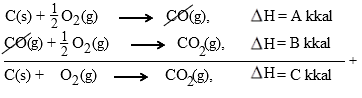
- Dari persamaan :Tentukan kalor pembentukan 1 mol karbon monooksida.
Pembahasan :
Untuk soal seperti ini, akan sangat membantu jika kita menyusun persamaan reaksi pembentukan 1 mol karbon monoksida terlebih dahulu. Adapun reaksi pembentukan karbon monoksida adalah sebagai berikut :
Dari persamaan di atas, perhatikan apa saja bagian pereaksi dan apa saja bagian hasil reaksi. Di bagian pereaksi (kiri) ada C dan O2 sedangkan di bagian hasil (kanan) ada CO. Oleh karena itu susunlah 2 persamaan yang diberikan pada soal menjadi sedemikian rupa sehingga pada bagian pereaksi terdapat atom C dan O2 sedangkan CO upayakan berada di sebelah kanan (bagian hasil).
Persamaan no 1 sudah sesuai dengan yang kita inginkan sehingga dapat kita tulis demikian sementara persamaan no 2, 2 mol CO berada di sebelah kiri oleh karena itu persamaan reaksinya harus kita balik karena kita menginginkan CO di bagian hasil reaksi (kanan). Karena dibalik, maka tanda negatif (-) pada entalpinya berubah menjadi positif (+). Selanjutnya, karena persamaan no 2 yang sudah dibalik menhasilkan 2 mol CO sementara kita menginginkan 1 mol CO, maka persamaan reaksinya dikali dengan 1/2 agar dihasilkan 1 mol CO. Karena persamaan reaksi dikali 1/2 maka entalpi reaksi juga dikali 1/2 seperti di bawah ini :
Jadi kalor yang dilepaskan untuk pembentukan 1 mol karbon monooksida adalah 109,5 kJ. - Bila diketahui ∆H pembentukan NH3 = -46 kJ/mol, maka tentukanlah entalpi reaksi 2NH3(g) → N2(g) + 3H2(g). Pembahasan>>
- Diketahui persamaan termokimia sebagai berikut : 2NO(g) + O2(g) → N2O4(g) ; ∆H = -A kJ
NO(g) + ½O2(g) → NO2(g) ; ∆H = -B kJ
Tentukan ∆H untuk reaksi 2NO2(g) → N2O4(g). Pembahasan>> - Diketahui persamaan termokimia sebagai berikut :MO2 + CO → MO + CO2 ; ∆H = -20 kJ
M3O4 + CO → 3MO + CO2 ; ∆H = +6 kJ
3M2O3 + CO → 2M3O4 + CO2 ; ∆H = -12 kJ
Tentukan nilai ∆H reaksi 2MO2(g) + CO → M2O3 + CO2. Pembahasan>>
- Bila diketahui persamaan termokimia seperti berikut :2Fe(s) + 3/2O2(g) → Fe2O3(s) ; ∆H = -839,6 kJ
2Al(s) + 3/2O2(g) → Al2O3(s) ; ∆H = +1.680 kJ
Tentukan ∆H untuk reaksi 2Al(s) + Fe2O3(s) → 2Fe(s) + Al2O3(s). Pembahasan>> - Reaksi pembentukan H2O(l) memiliki entalpi -285 kJ/mol, reaksi pembentukan CO2 -393 kJ/mol, dan reaksi pembentukan C2H2(g) memiliki entalpi +227 kJ/mol. Tentukanlah jumlah kalor yang dibebaskan pada pembakaran 0,52 gram gas C2H2 (Mr = 26). Pembahasan>>
- Diketahui perubahan entalpi untuk reaksi pembentukan CH4, CO2, dan H2O adalah sebagai berikut : C(s) + 2H2(g) → CH4(g); ∆H = -75 kJ
C(s) + O2(g) → CO2(g); ∆H = -394 kJ
H2(g) + ½O2(g) → H2O(g); ∆H = -286 kJ
Tentukan perubahan entalpi reaksi CH4(g) + 2O2(g) → CO2(g) + 2H2O(g). Pembahasan>> - Diketahui persamaan termokimia sebagai berikut : NH3 + air → larutan NH4OH ; ∆H = +a kal
HCl + air → larutan HCl ; ∆H = +b kal
larutan NH4OH + larutan HCl → larutan NH4Cl ; ∆H = +c kal
NH3 + HCl → NH4Cl ; ∆H = +d kal
NH4Cl + air → larutan NH4Cl ; ∆H = +e kal
Tentukan hubungan a, b, c, d, dan e menurut Hukum Hess. Pembahasan>>
Edutafsi.com adalah blog tentang bahan belajar. Gunakan menu atau penelusuran untuk menemukan bahan belajar yang ingin dipelajari.
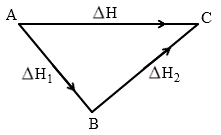
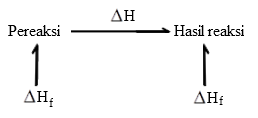
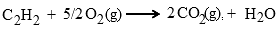
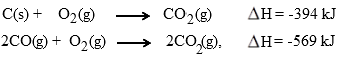
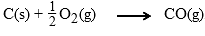

0 comments :
Post a Comment