Edutafsi.com - Daya Hantar Larutan Elektrolit. Pada pembahasan sebelumnya telah dijelaskan bahwa berdasarkan daya hantar listriknya, secara umum larutan dapat dikelompokkan menjadi dua kelompok, yaitu larutan elektrolit dan larutan nonelektrolit. Larutan elektrolit adalah larutan yang dapat menghantarkan listrik sedangkan larutan nonelektrolit adalah larutan yang tidak dapat menghantarkan listrik. Lalu munculnya sebuah pertanyaan mendasar mengenai gejala kelistrikan pada larutan tersebut, yaitu mengapa larutan elektrolit dapat menghantarkan listrik sementara larutan nonelektrolit tidak bisa?
Sebelum terjawab, pertantanyaan tersebut mulanya menjadi pekerjaan rumah bagi para ilmuwan pada masa itu. Sejumlah ilmuwan kemudian mencoba mengemukakan teori mereka untuk menjelaskan penyebab gejala hantaran listrik pada larutan elektrolit.
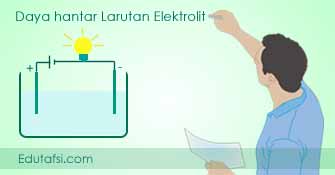
Pada uji hantaran listrik yang dilakukan pada berbagai larutan terdapat dua gejala yang menjadi ciri dari larutan elektrolit sekaligus sebagai pertanda bahwa larutan itu dapat menghantarkan listrik. Gejala tersebut adalah munculnya gelembung gas dalam larutan dan menyalanya lampu indikator.
Menyalanya lampu indikator pada pengujian daya hantar listrik larutan menunjukkan bahwa ada arus listrik yang mengalir melalui larutan. Namun kesimpulan tersebut tidak cukup untuk menjelaskan mengapa gejala kelistrikan itu hanya terjadi pada larutan elektrolit.
Satu-satunya titik terang yang tersisa adalah munculnya gelembung gas pada larutan elektrolit. Munculnya gelembung gas pada larutan elektrolit bisa jadi merupakan jawaban dari sifat hantaran listrik yang dimilikinya sebab larutan nonelektrolit sama sekali tidak menghasilkan gelembung gas tersebut.
Teori ionisasi yang dijaukan Arrhenius menjelaskan bahwa larutan elektrolit dapat menghantarkan arus listrik sebab larutan elektrolit mengandung ion-ion yang dapat bergerak bebas. Ion-ion tersebutlah yang menghantarkan listrik melalui larutan elektrolit.
Larutan elektrolit mengandung ion-ion yang dapat bergerak bebas karena pada larutan tersebut terjadi ionisasi. Ketika senyawa elektrolit dilarutkan dalam air, maka senyawa akan terurai membentuk ion positif dan ion negatif.
Timbulnya gelembung gas di dalam larutan elektrolit merupakan salah satu indikator bahwa di dalam larutan tersebut berlangsung ionisasi atau pembentukan ion-ion. Pada larutan elektrolit kuat, senyawa elektrolit terurai sempurna sehingga dihasilkan banyak ion dan daya hantarnya baik.
Sedangkan pada larutan elektrolit lemah, senyawa elektrolit yang dilarutkan dalam air hanya mengalami ionisasi sebagian sehingga ion yang dihasilkan tidak sebanyak larutan elektrolit kuat dan akibatnya, daya hantar listriknya juga buruk.
Larutan nonelektrolit tidak dapat menghantarkan listrik karena saat senyawa nonelektrolit dilarutkan dalam air, senyawa tersebut tidak megalami ionisasi sehingga masih dalam bentuk senyawa. Karena tidak ada ion yang bergerak bebas, maka larutan itu tidak dapat menghantarkan listrik.
Elektrolisis adalah peristiwa penguraian suatu elektrolit oleh arus listrik. Peristiwa ini menghasilkan gelembung gas dalam larutan elektrolit. Gelembung tersebut timbul karena ion positif mengalami reaksi reduksi dan ion negatif mengalami oksidasi.
Sebagai contoh, pada larutan asam klorida (HCl) terjadi elektrolisis dengan reaksi sebagai berikut:
Reaksi ionisasi : HCl(aq) → H+(aq) + Cl-(aq)
Reaksi reduksi : 2H+ + 2e- → H2(g)
Reaksi oksidasi : 2Cl-(aq) → Cl2(g) + 2e-
Dari penjabaran di atas, maka dapat ditarik sebuah kesimpulan sebagai jawaban atas pertanyaan mengenai gejala hantaran listrik pada larutan. Larutan elektrolit dapat menghantarkan listrik karena pada larutan elektrolit terdapat ion-ion yang dapat bergerak bebas. Ion tersebutlah yang menghantarkan listrik melalui larutan.
Demikianlah pembahasan singkat mengenai alasan mengapa larutan elektrolit dapat menghantarkan listrik sementara larutan nonelektrolit tidak. Jika artikel yang anda baca bermanfaat, silahkan bagikan kepada teman anda melalui tombol share yang tersedia.
Sebelum terjawab, pertantanyaan tersebut mulanya menjadi pekerjaan rumah bagi para ilmuwan pada masa itu. Sejumlah ilmuwan kemudian mencoba mengemukakan teori mereka untuk menjelaskan penyebab gejala hantaran listrik pada larutan elektrolit.
Pada uji hantaran listrik yang dilakukan pada berbagai larutan terdapat dua gejala yang menjadi ciri dari larutan elektrolit sekaligus sebagai pertanda bahwa larutan itu dapat menghantarkan listrik. Gejala tersebut adalah munculnya gelembung gas dalam larutan dan menyalanya lampu indikator.
Menyalanya lampu indikator pada pengujian daya hantar listrik larutan menunjukkan bahwa ada arus listrik yang mengalir melalui larutan. Namun kesimpulan tersebut tidak cukup untuk menjelaskan mengapa gejala kelistrikan itu hanya terjadi pada larutan elektrolit.
Satu-satunya titik terang yang tersisa adalah munculnya gelembung gas pada larutan elektrolit. Munculnya gelembung gas pada larutan elektrolit bisa jadi merupakan jawaban dari sifat hantaran listrik yang dimilikinya sebab larutan nonelektrolit sama sekali tidak menghasilkan gelembung gas tersebut.
A. Teori Ionisasi Arrhenius
Pada tahun 1887 seorang ahli kimia dari Swedia mengemukaan sebuah teori yang menjawab pertanyaan mengapa larutan elektrolit dapat menghantarkan listrik. Ilmuwan tersebut adalah Svante August Arrhenius. Beliau mengemukaan teori ion yang memberikan penjelasan memuaskan atas pertanyaan tersebut.Teori ionisasi yang dijaukan Arrhenius menjelaskan bahwa larutan elektrolit dapat menghantarkan arus listrik sebab larutan elektrolit mengandung ion-ion yang dapat bergerak bebas. Ion-ion tersebutlah yang menghantarkan listrik melalui larutan elektrolit.
Larutan elektrolit mengandung ion-ion yang dapat bergerak bebas karena pada larutan tersebut terjadi ionisasi. Ketika senyawa elektrolit dilarutkan dalam air, maka senyawa akan terurai membentuk ion positif dan ion negatif.
Timbulnya gelembung gas di dalam larutan elektrolit merupakan salah satu indikator bahwa di dalam larutan tersebut berlangsung ionisasi atau pembentukan ion-ion. Pada larutan elektrolit kuat, senyawa elektrolit terurai sempurna sehingga dihasilkan banyak ion dan daya hantarnya baik.
Sedangkan pada larutan elektrolit lemah, senyawa elektrolit yang dilarutkan dalam air hanya mengalami ionisasi sebagian sehingga ion yang dihasilkan tidak sebanyak larutan elektrolit kuat dan akibatnya, daya hantar listriknya juga buruk.
Larutan nonelektrolit tidak dapat menghantarkan listrik karena saat senyawa nonelektrolit dilarutkan dalam air, senyawa tersebut tidak megalami ionisasi sehingga masih dalam bentuk senyawa. Karena tidak ada ion yang bergerak bebas, maka larutan itu tidak dapat menghantarkan listrik.
B. Percobaan Michael Faraday
Munculnya gelembung gas pada hasil uji kehantaran larutan juga dapat dijelaskan dengan percobaan yang dilakukan oleh Michael Faraday. Berdasarkan percobaan tersebut, diketahui bahwa jika ke dalam larutan elektrolit dialirkan arus listrik, maka akan terjadi elektrolisis.Elektrolisis adalah peristiwa penguraian suatu elektrolit oleh arus listrik. Peristiwa ini menghasilkan gelembung gas dalam larutan elektrolit. Gelembung tersebut timbul karena ion positif mengalami reaksi reduksi dan ion negatif mengalami oksidasi.
Sebagai contoh, pada larutan asam klorida (HCl) terjadi elektrolisis dengan reaksi sebagai berikut:
Reaksi ionisasi : HCl(aq) → H+(aq) + Cl-(aq)
Reaksi reduksi : 2H+ + 2e- → H2(g)
Reaksi oksidasi : 2Cl-(aq) → Cl2(g) + 2e-
Dari penjabaran di atas, maka dapat ditarik sebuah kesimpulan sebagai jawaban atas pertanyaan mengenai gejala hantaran listrik pada larutan. Larutan elektrolit dapat menghantarkan listrik karena pada larutan elektrolit terdapat ion-ion yang dapat bergerak bebas. Ion tersebutlah yang menghantarkan listrik melalui larutan.
Demikianlah pembahasan singkat mengenai alasan mengapa larutan elektrolit dapat menghantarkan listrik sementara larutan nonelektrolit tidak. Jika artikel yang anda baca bermanfaat, silahkan bagikan kepada teman anda melalui tombol share yang tersedia.
Edutafsi.com adalah blog tentang bahan belajar. Gunakan menu atau penelusuran untuk menemukan bahan belajar yang ingin dipelajari.