Edutafsi.com - Larutan Elektrolit dan Larutan Nonelektrolit. Apa perbedaan antara larutan elektrolit dan larutan elektrolit? Mengapa larutan elektrolit dapat menghantarkan listrik sementara larutan nonelektrolit tidak? Pada artikel sebelumnya, edutafsi telah membahas pengertian larutan elektrolit dan larutan nonelektrolit beserta contohnya. Pada pembahasan tersebut sekilas telah diutarakan beberapa perbedaan antara larutan elektrolit dan larutan nonelektrolit. Dari pengertian kedua jenis larutan tersebut, maka jelas salah satu perbedaan antara larutan elektrolit dan larutan nonelektrolit terletak pada daya hantar listriknya. Selain daya hantar, berikut akan dibahas beberapa perbedaan antara larutan elektrolit dan nonelektrolit.
Pada mulanya, setelah diketahui bahwa ada larutan yang dapat menghantar listrik dan ada yang tidak dapat menghantar listrik, para peneliti kemudian menjadi penasaran akan alasan mengapa larutan elektrolit dapat menghantarkan listrik.
Pertanyaan tersebut akhirnya dapat dijelaskan dengan baik oleh teori ionisasi yang diajukan oleh Arrhenius. Menurut teori ionisasi, larutan elektrolit dapat menghantarkan listrik karena mengandung ion-ion yang dapat bergerak bebas.
Arrhenius menjelaskan bahwa zat elektrolit yang dilarutkan ke dalam air akan terionisasi dan membentuk ion positif dan ion negatif yang dapat bergerak bebas. Ion-ion tersebutlah yang kemudian menghantarkan arus listrik melalui larutan.
Sementara itu, ketika zat-zat nonelektrolit dilarutkan ke dalam air, zat tersebut tidak akan mengalami ionisasi sehingga masih dalam bentuk molekul dan tidak terbentuk ion. Karena tidak ada ion-ion yang bergerak bebas, maka larutan tersebut tidak dapat menghantar listrik.
Secara garis besar, perbedaan antara larutan elektrolit dan larutan nonelektrolit dapat ditinjau dari lima aspek, yaitu berdasarkan daya hantar listriknya, gejala dalam uji elektrolit, ionisasi dan derajat ionisasi, serta polarisasi.
#1 Daya Hantar Listrik
Sesuai dengan definisinya, maka jelas perbedaan antara larutan elektrolit dan larutan nonelektrolit dapat dilihat dari daya hantar listriknya. Kalau larutan elektrolit dapat menghantar listrik melalui larutan sedangkan larutan nonelektrolit tidak dapat mengahantarkan listrik.
Ditinjau dari daya hantarnya, larutan elektrolit pun masih dapat dibedakan menjadi larutan elektrolit kuat dan elektrolit lemah. Larutan elektrolit kuat dapat menghantar arus listrik dengan baik sedangkan larutan elektrolit lemah memiliki daya hantar yang buruk.
#2 Gejala Hantaran
Pada uji daya hantar listrik untuk larutan, terdapat gejala hantaran listrik yang dapat diamati. Gejala tersebut adalah munculnya gelembung gas pada larutan sebagai akibat dari ionisasi dan menyalanya lampu indikator sebagai tanda bahwa listrik dihantarkan.
Pada pengujian, larutan elektrolit menunjukkan kedua gejala tersebut, yaitu adanya gelembung gas dan nyala lampu. Untuk elektrolit lemah, nayala lampu redup atau bahkan tidak menyala. Sementara pada larutan nonelektrolit, tidak ada gejala gelembung gas dan nyala lampu.
#3 Polarisasi
Dari ada tidaknya kutub atau polar, larutan elektrolit mempunyai dua kutub atau polar yaitu kutub positif dan kutub negatif. Hal ini berkaitan dengan proses ionisasi yang berlangsung pada larutan elektrolit. Sedangkan pada larutan nonelektrolit tidak terbentuk kutub atau polar.
#4 Ionisasi
Ionisasi adalah proses terbentuknya ion-ion dalam larutan. Pada larutan elektrolit berlangsung ionisasi sehingga terbentuk ion-ion yang bebas bergerak sedangkan pada larutan nonelektrolit tidak terjadi ionisasi.
Pada larutan elektrolit juga dapat dilihat perbedaan antara elektrolit lemah dan elektrolit kuat dalam hal ionisasi. Elektrolit kuat mengalami ionisasi sempurna membentuk ion positif dan ion negatif sedangkan elektrolit lemah hanya terurai sebagian.
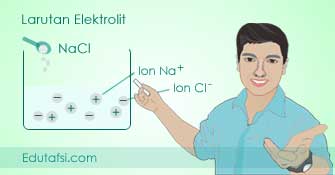
Ilustrasi tersebut menunjukkan garam dapur NaCl yang merupakan zat elektrolit dilarutkan ke dalam air. Elektrolit NaCl mengalami ionisasi dan terurai menjadi ion Na+ dan ion Cl-.
#5 Derajat Ionisasi
Karena larutan elektrolit mengalami ionisasi, ada yang terurai sempurna dan ada yang terturai sebagian, maka larutan elektrolit memiliki derajat ionisasi. Derajat ionisasi untuk larutan elektrolit adalah 0 < α ≤ 1, sedangkan larutan elektrolit derajat ioniasinya adalah α = 0.
Demikianlah penjelasan singkat mengenai perbedaan antara larutan elektrolit dan larutan nonelektrolit. Jika artikel yang anda baca bermanfaat, silahkan bagi kepada teman anda melalui tombol share yang tersedia.
A. Teori Ion Arrhenius
Sebelum membahas perbedaan antara larutan elektrolit dan larutan nonelektrolit, maka kita perlu mengetahui teori ion yang diajukan oleh Svante Arrhenius. Teori tersebut merupakan teori yang paling memuaskan dalam menjelaskan sifat daya hantar yang ada pada larutan elektrolit.Pada mulanya, setelah diketahui bahwa ada larutan yang dapat menghantar listrik dan ada yang tidak dapat menghantar listrik, para peneliti kemudian menjadi penasaran akan alasan mengapa larutan elektrolit dapat menghantarkan listrik.
Pertanyaan tersebut akhirnya dapat dijelaskan dengan baik oleh teori ionisasi yang diajukan oleh Arrhenius. Menurut teori ionisasi, larutan elektrolit dapat menghantarkan listrik karena mengandung ion-ion yang dapat bergerak bebas.
Arrhenius menjelaskan bahwa zat elektrolit yang dilarutkan ke dalam air akan terionisasi dan membentuk ion positif dan ion negatif yang dapat bergerak bebas. Ion-ion tersebutlah yang kemudian menghantarkan arus listrik melalui larutan.
Sementara itu, ketika zat-zat nonelektrolit dilarutkan ke dalam air, zat tersebut tidak akan mengalami ionisasi sehingga masih dalam bentuk molekul dan tidak terbentuk ion. Karena tidak ada ion-ion yang bergerak bebas, maka larutan tersebut tidak dapat menghantar listrik.
B. Perbandingan Larutan Elektrolit dan Nonelektrolit
Teori ionisasi yang diajukan Arrhenius tidak hanya berhasil menjawab pertanyaan mengenai penyebab munculnya kemampuan larutan elektrolit dalam menghantar listrik, tapi juga dapat memberikan beberapa poin lagi yang membedakan larutan elektrolit dengan nonelektrolit.Secara garis besar, perbedaan antara larutan elektrolit dan larutan nonelektrolit dapat ditinjau dari lima aspek, yaitu berdasarkan daya hantar listriknya, gejala dalam uji elektrolit, ionisasi dan derajat ionisasi, serta polarisasi.
#1 Daya Hantar Listrik
Sesuai dengan definisinya, maka jelas perbedaan antara larutan elektrolit dan larutan nonelektrolit dapat dilihat dari daya hantar listriknya. Kalau larutan elektrolit dapat menghantar listrik melalui larutan sedangkan larutan nonelektrolit tidak dapat mengahantarkan listrik.
Ditinjau dari daya hantarnya, larutan elektrolit pun masih dapat dibedakan menjadi larutan elektrolit kuat dan elektrolit lemah. Larutan elektrolit kuat dapat menghantar arus listrik dengan baik sedangkan larutan elektrolit lemah memiliki daya hantar yang buruk.
#2 Gejala Hantaran
Pada uji daya hantar listrik untuk larutan, terdapat gejala hantaran listrik yang dapat diamati. Gejala tersebut adalah munculnya gelembung gas pada larutan sebagai akibat dari ionisasi dan menyalanya lampu indikator sebagai tanda bahwa listrik dihantarkan.
Pada pengujian, larutan elektrolit menunjukkan kedua gejala tersebut, yaitu adanya gelembung gas dan nyala lampu. Untuk elektrolit lemah, nayala lampu redup atau bahkan tidak menyala. Sementara pada larutan nonelektrolit, tidak ada gejala gelembung gas dan nyala lampu.
#3 Polarisasi
Dari ada tidaknya kutub atau polar, larutan elektrolit mempunyai dua kutub atau polar yaitu kutub positif dan kutub negatif. Hal ini berkaitan dengan proses ionisasi yang berlangsung pada larutan elektrolit. Sedangkan pada larutan nonelektrolit tidak terbentuk kutub atau polar.
#4 Ionisasi
Ionisasi adalah proses terbentuknya ion-ion dalam larutan. Pada larutan elektrolit berlangsung ionisasi sehingga terbentuk ion-ion yang bebas bergerak sedangkan pada larutan nonelektrolit tidak terjadi ionisasi.
Pada larutan elektrolit juga dapat dilihat perbedaan antara elektrolit lemah dan elektrolit kuat dalam hal ionisasi. Elektrolit kuat mengalami ionisasi sempurna membentuk ion positif dan ion negatif sedangkan elektrolit lemah hanya terurai sebagian.
Ilustrasi tersebut menunjukkan garam dapur NaCl yang merupakan zat elektrolit dilarutkan ke dalam air. Elektrolit NaCl mengalami ionisasi dan terurai menjadi ion Na+ dan ion Cl-.
#5 Derajat Ionisasi
Karena larutan elektrolit mengalami ionisasi, ada yang terurai sempurna dan ada yang terturai sebagian, maka larutan elektrolit memiliki derajat ionisasi. Derajat ionisasi untuk larutan elektrolit adalah 0 < α ≤ 1, sedangkan larutan elektrolit derajat ioniasinya adalah α = 0.
Demikianlah penjelasan singkat mengenai perbedaan antara larutan elektrolit dan larutan nonelektrolit. Jika artikel yang anda baca bermanfaat, silahkan bagi kepada teman anda melalui tombol share yang tersedia.
Edutafsi.com adalah blog tentang bahan belajar. Gunakan menu atau penelusuran untuk menemukan bahan belajar yang ingin dipelajari.